Закон Бойля-Маріотта – історія відкриття першого газового закону
- Ігор Сальниченко
- 9 серп. 2025 р.
- Читати 14 хв
Закон Бойля-Маріотта (інша назва – перший газовий закон) описує фундаментальну залежність між тиском і об’ємом газу за незмінної температури. Цю емпіричну залежність відкрили незалежно один від одного англійський натурфілософ Роберт Бойль (1627–1691) та французький фізик Едме Маріотт (1620–1684) у XVII столітті. Згідно із законом Бойля-Маріотта, для даної маси газу за сталої температури добуток його тиску (p) на об’єм (V) є величиною постійною: p · V = const [4]. Інакше кажучи, об’єм газу обернено пропорційний до тиску. Якщо стискати газ (зменшувати його об’єм), тиск зростає, і навпаки – розширення газу призводить до падіння його тиску[7]. Наприклад, коли поршень шприца вдвічі зменшує об’єм повітря всередині, тиск повітря приблизно подвоюється; саме тому для накачування шини треба прикладати зусилля, що стискає повітря і підвищує його тиск. Ця проста залежність має глибокі наслідки: вона пояснює, чому стиснене повітря виявляє “пружність” (еластичність), як працюють насоси і людські легені, а також чому зміна атмосферного тиску пов’язана зі змінами погоди[1].

Науковий контекст XVII століття: виникнення вакуумної техніки та досліди Торрічеллі й Паскаля
На час відкриття закону Бойля-Маріотта наука переживала становлення експериментальної фізики. У XVII столітті поступово руйнувалися засади арістотелівської натурфілософії, за якою повітря вважалося однією з чотирьох стихій, а vacuum (порожнеча) – неможливим станом природи (“horror vacui” – «жах перед порожнечею»). Під впливом ідей Галілея зароджувалося нове розуміння “океану повітря”, що оточує Землю. Перші кількісні досліди з атмосферним тиском здійснив 1643 року італійський учений Евангеліста Торрічеллі (1608–1647), учень Галілея. Він заповнив довгу скляну трубку ртуттю та перевернув її у відкриту посудину з ртуттю; стовпчик ртуті в трубці опустився, залишивши зверху порожній простір – перший створений людиною вакуум, розмір якого змінювався залежно від атмосферного тиску[6]. Цей “торрічеллієв вакуум” довів, що порожнеча може існувати, а повітря має вагу і тиск.
Французький вчений Блез Паскаль (1623–1662) негайно зацікавився дослідом Торрічеллі. У 1648 році він організував експедицію на гору Пюї-де-Дом у Франції: на різних висотах піднімали ртутний барометр і спостерігали зменшення висоти ртутного стовпа на вершинах гір[6]. Цей історичний експеримент Паскаля продемонстрував, що атмосферний тиск спадає з висотою, тобто «море повітря» тисне на нас і його “стовп” над головою стає меншим при сходженні вгору. Відтак було остаточно спростовано стару доктрину про неможливість порожнечі, а повітря утвердилося як об’єкт точних фізичних досліджень. Паскаль також сформулював закон про передачу тиску в рідинах (закон Паскаля) і вивчав механіку рідин і газів, заклавши підвалини гідростатики та аеростатики.

Наступним кроком у розвитку “вакуумної техніки” стало створення пристроїв для відкачування повітря. 1654 року німецький інженер та фізик Отто фон Ґеріке (1602–1686) сконструював перший повітряний насос і вразив європейську публіку своїм дослідом із маґдебурзькими півкулями. Він з’єднав дві порожні мідні півкулі, відкачав із них повітря насосом, після чого дві запряжені у протилежні боки упряжки коней не змогли розірвати вакуумну кулю – півкулі міцно стискалися атмосферним тиском[6]. Досліди Ґеріке наочно продемонстрували силу “пружності” повітря і відкрили шлях до лабораторного вивчення газів. До середини XVII ст. створення вакууму перестало бути чудом: з’явилися інструменти (ртутні барометри, насоси), за допомогою яких вчені могли експериментувати з розрідженим повітрям і вимірювати тиск. На цьому тлі англійські й французькі дослідники майже одночасно підійшли до відкриття кількісного закону для газу.
Роберт Бойль (1627–1691) – піонер експериментальної науки і відкривач «пружності повітря»
Роберт Бойль походив із знатної ірландської родини (сьомий син графа Корка) і став одним із засновників наукової революції в Англії. Він увійшов в історію як один із «батьків сучасної хімії» та піонер експериментального методу в науці[1]. 1660 року Бойль оселився в Оксфорді, де разом з молодим помічником Робертом Гуком (1635–1703) почав проводити досліди з повітряним насосом власної конструкції[3]. Бойль докладно описав ці експерименти у знаменитій книзі «Нові фізико-механічні експерименти, що стосуються пружності повітря та її наслідків» (New Experiments Physico-Mechanical, Touching the Spring of the Air, and its Effects, 1660).

Термін «spring of the air»(буквально «пружина повітря») означав здатність повітря пружно стискатися і розширюватися. У своїй книзі Бойль навів 43 різноманітні експерименти з насосом і повітрям. Наприклад, він показав, що в розрідженому повітрі гірше поширюється звук, швидше випаровуються рідини і гасне полум’я, а живі істоти не можуть існувати без повітря[1]. Ці досліди довели, що повітря має фізичні властивості й тиск, необхідні для життя (дихання, горіння тощо)[2]. Бойль фактично створив вакуум (або близький до вакууму стан) у лабораторних умовах, спростувавши авторитетну тоді тезу Арістотеля про “жах порожнечі”. Його праця викликала резонанс і критику з боку прихильників схоластичної науки, адже ставила під сумнів вчення про чотири стихії та інші догми старої натурфілософії[1].
Бойль був не лише експериментатором, а й природодослідником зі сміливими теоретичними ідеями.
У трактаті «Скептичний хімік» (1661) він піддав критиці арістотелівську теорію стихій і алхімічні уявлення, висунувши натомість корпускулярну гіпотезу – ідею, що матерія складається з дрібних часток («корпускул»), які можуть сполучатися в різних комбінаціях[3]. Цим він передбачив поняття хімічних елементів і заклав основи сучасної хімії. Уявляючи газ як сукупність корпускул, Бойль пояснював його пружність наявністю невидимих «пружин» між частками[8]. Незважаючи на брак прямих доказів існування атомів у XVII ст., Бойль інтуїтивно використовував атомістичні ідеї для пояснення своїх результатів. Такий підхід був новаторським і наштовхнувся на «енергійний опір» консервативних вчених, які вважали атоми лише недоведеною гіпотезою[7]. Однак Бойль наполягав на тому, що наука повинна спиратися на дослід, а не на догми авторитетів. У 1660 році він став одним із засновників Лондонського Королівського товариства – першого наукового об’єднання нового типу з девізом Nullius in verba («Нікому на слово»), що підкреслював відданість емпіричному знанню[1].

Основний науковий подвиг Роберта Бойля – відкриття кількісного закону для стисливості газів. Під час своїх дослідів із насосом та ртутним манометром Бойль помітив математичний зв’язок між об’ємом повітря і тиском. Ця залежність була опублікована 1662 року в додатку до другого видання його книги про пружність повітря. Бойль не сформулював закон словами, але представив таблицю вимірювань, з якої уважний читач міг виявити шукану закономірність. У експерименті Бойль використав J-подібну скляну трубку: коротке плече трубки було запаяне і в ньому була «заточена» певна кількість повітря, а довге плече залишалося відкритим. Вливаючи ртуть у трубку, вчений підвищував тиск на захоплений у короткому коліні об’єм повітря і спостерігав, як той стискається. Вимірюючи висоту ртутного стовпа, Бойль визначав створений тиск, а за позначкою рівня ртуті в запаяному коліні – відповідний об’єм повітря[1]. Повторивши дослід багато разів з різною кількістю ртуті, він побачив, що добуток числових значень тиску і об’єму залишається практично сталим. Так Бойль дійшов висновку, що об’єм повітря обернено пропорційний тиску. У першій публікації 1662 року цей висновок називався “законом пружності повітря” і був поданий у вигляді таблиці та графіка, близького до гіперболи Формулювання у сучасному вигляді (p · V = const при сталих масі й температурі газу) з’явилося пізніше, у працях інших вчених. Проте пріоритет Бойля був загальновизнаний: на його честь залежність отримала назву «закон Бойля» (поза Францією). Це був перший в історії фізики кількісний закон, виражений рівнянням, що пов’язує дві змінні величини[7].
Таким чином, Роберт Бойль зробив визначний внесок у науку як відкривач фундаментального газового закону і як популяризатор експериментального підходу. За життя він здобув величезну славу: його називали “чудом нашої оксфордської нової філософії”. Бойль показав приклад нового наукового мислення – поєднання точного експерименту з сміливим теоретичним осмисленням. Його роботи надихнули сучасників, зокрема молодого Ісаака Ньютона, який уважно вивчав праці Бойля[1].
Едме Маріотт (1620–1684) – незалежне відкриття закону у Франції
На той час, коли відкриття Бойля стало відомим у Англії, у Франції зростав новий осередок науки – Паризька Академія наук (заснована 1666 року під патронатом Ж.-Б. Кольбера). Серед перших членів Академії був Едме Маріотт – католицький абат і допитливий природодослідник з Бургундії[2]. Маріотт здобув репутацію одного з перших французьких експериментаторів, хто запровадив у фізику «дух спостереження і сумніву», за висловом французького просвітника Кондорсе [5]. Як священнослужитель, він не мав університетського звання, зате присвятив своє дозвілля науці і був нагороджений за наукові заслуги посадою настоятеля монастиря Сен-Мартен-сус-Бон (поблизу Діжона). Маріотт організував при дворі французького короля демонстрації цікавих дослідів, дивуючи публіку природничими «фокусами».
Зокрема, ще в 1660 році він відкрив явище сліпої плями ока – продемонстрував, що маленький предмет, розміщений під певним кутом щодо ока, зникає з поля зору, якщо його зображення потрапляє на точку виходу зорового нерва[8]. Цей фокус із «чарівним зникненням монети» справив фурор при дворі і заклав основу для відкриття анатомічної сліпої плями на сітківці. Маріотт цікавився різними галузями: проводив гідростатичні досліди, досліджував рух рідин, удар кулі маятника, природу звуку і кольору. Він удосконалив маятникові прилади для вивчення зіткнень (винайшов пристрій, відомий нині як «колиска Ньютона», в якому кулі на нитках передають імпульс при ударах)[5]. Також учений сконструював «пляшку Маріотта» – спеціальний посуд для підтримання сталого витікання рідини, що використовується й досі в експериментах з гідродинаміки. В галузі біології він досліджував сокорух у рослинах і висловив здогад, що рослини здійснюють хімічний синтез поживних речовин, різний у кожного виду – здогад, який підтвердився лише через багато десятиліть[2].

Попри таку широту інтересів, найбільше прославило ім’я Маріотта саме дослідження повітря. Він уважно стежив за відкриттями Торрічеллі та Паскаля і сам виконував досліди з ртутним барометром. До речі, саме Маріотт запровадив у 1676 році термін “барометр” (від грец. baros – вага, тиск) для назви ртутного манометра Торрічеллі. У 1670-х роках Маріотт проводив серію експериментів зі стиснення повітря, подібних до бойлевих. Він, імовірно, не був знайомий із точними кількісними результатами Бойля (праці англійських колег не відразу ставали відомими на континенті через брак комунікації та мовний бар’єр). Тому, працюючи у Франції, Маріотт повторно відкрив те саме фізичне правило, що й Бойль. Свої результати він оприлюднив у 1676 році в трактаті «Роздуми про природу повітря» (Discours de la nature de l’air)[2]. Маріотт чітко сформулював закон оберненої пропорційності між об’ємом повітря і тиском: “зменшення об’єму повітря відбувається пропорційно до вантажу, яким воно навантажене” – писав він, маючи на увазі тиск, створений стовпом ртуті[5].
Сучасною мовою ця фраза означає: p підвищується, коли V зменшується, і навпаки, причому кількісно p · V = const. Важливо, що Маріотт додав суттєве уточнення: наведена залежність виконується лише за умови, що температура газу не змінюється[1][2]. Іншими словами, він першим вказав на ізотермічний характер закону. Маріотт, як і Бойль, дійшов свого відкриття через експеримент. Але, на відміну від Бойля, він більше акцентував увагу не на теоретичних поясненнях, а на точності вимірювань і умовах проведення досліду. Його стиль – «спитати природу, нічого не нав’язуючи їй» – відображав новий науковий метод у французькій академічній традиції.

У 1679 році роботи Маріотта стали широко відомі в Європі, і стало очевидно, що закон пружності газу був відкритий двома людьми паралельно (через що він має подвійну назву). У самій Франції закон почали називати «законом Маріотта», віддаючи належне вітчизняному вченому[1]. Едме Маріотт помер у 1684 році, але його наукова спадщина була значною. У 1681 році Академія наук посмертно видала зібрання його творів, де серед іншого був трактат “De la nature de l’air” з формулюванням газового закону. Французькі науковці XVIII століття спиралися на досліди Маріотта в оптиці, гідравліці та акустиці. Сам Ісаак Ньютон посилався на роботи Маріотта у своїх «Математичних началах натуральної філософії» (1687), зокрема, згадував його досліди з маятниками і зіткненнями куль[8]. Хоча Ньютон не пропонував нового пояснення закону пружності газів, авторитет його і Бойля утвердив цей закон в очах наукової спільноти. Маріотт залишив по собі образ скромного, але наполегливого експериментатора, котрий вмів ставити хитромудрі досліди і отримувати з них чіткі узагальнення. Його внесок – незалежне підтвердження та уточнення газового закону – зміцнив віру в універсальність відкритого Бойлем явища.
Формулювання закону Бойля-Маріотта та пояснення його суті
У сучасному вигляді закон Бойля-Маріотта формулюється так: для даної маси газу за сталої температури його тиск обернено пропорційний об’єму. Математично це можна записати рівнянням p · V = const, або для двох станів одного й того самого газу: p₁V₁ = p₂V₂. Іншими словами, якщо збільшити об’єм газу, його тиск пропорційно зменшиться, і навпаки[7]. При ізотермічному стисканні газу вдвічі (V₂ = V₁/2) тиск зростає вдвічі (p₂ = 2p₁); якщо ж об’єм розширити, скажімо, в 3 рази, то тиск впаде утричі тощо. Графічно залежність p(V) при сталих масі й температурі має вигляд гіперболи. Ця закономірність, встановлена для повітря, виявилася справедливою і для всіх інших газів за нормальних умов. Сам Бойль і Маріотт не користувалися поняттям температури в сучасному розумінні – вони просто проводили досліди при кімнатній температурі, не нагріваючи і не охолоджуючи газ. Але подальші досліди показали, що при нагріванні газу його тиск зростає, тому закон зберігається тільки при незмінній температурі (ізотермічно). За цим законом гази поводяться тим більш точно, чим далі вони від точок конденсації – тобто для ідеального газу закон виконується точно, а реальні гази є лише його наближенням. На практиці за помірних тисків і температур реальні гази достатньо точно підкоряються співвідношенню p · V ≈ const; відхилення (через міжмолекулярні взаємодії) спостерігаються при дуже високих тисках або низьких температурах, коли газ «відходить» від ідеальної моделі[7]. Для врахування таких відхилень вводять поправковий коефіцієнт стисливості газу, але в межах класичної термодинаміки закон Бойля-Маріотта вважається точним для ідеальних газів.
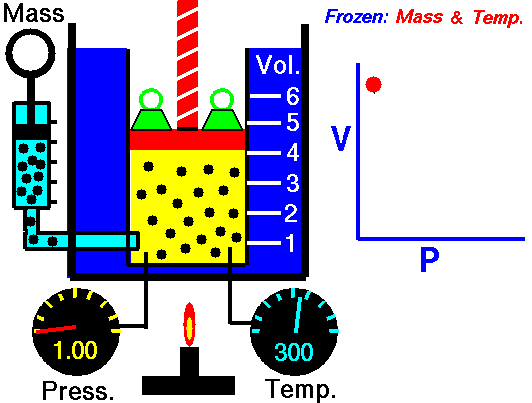
Фізичний зміст закону Бойля-Маріотта полягає в тому, що газ має властивість пружності: його частинки (молекули) рухаються хаотично і при стисканні починають частіше зіштовхуватися зі стінками посудини, створюючи більший тиск. З точки зору молекулярно-кінетичної теорії, при сталому середньому тепловому русі частинок (тобто постійній температурі) зменшення об’єму просто підвищує частоту ударів молекул об стінки, що й викликає пропорційне зростання тиску. І навпаки, розширення об’єму дає молекулам більше простору, зіткнення зменшуються – тиск падає. Бойль і Маріотт відкрили цей закон суто емпірично, не знаючи про існування атомів чи молекул. Проте їхні експерименти стали першим кроком до підтвердження атомістичних уявлень: у XVIII–XIX століттях, коли зародилася кінетична теорія газів, закон Бойля-Маріотта знайшов природне пояснення на основі моделей пружних зіткнень молекул[7].

У повсякденному житті прояви закону Бойля-Маріотта можна спостерігати в різних ситуаціях. Наприклад, робота поршневих насосів і компресорів базується на стисканні газу: коли поршень стискає повітря в камері в кілька разів, тиск у ній відповідно зростає, що дозволяє нагнітати повітря в шини чи резервуари. При цьому повітря навіть нагрівається – адже реальний процес не є ідеально ізотермічним, частина механічної енергії переходить в тепло. Інший приклад – дихання людини. Коли ми розширюємо грудну клітку (вдихаємо), об’єм легень збільшується і тиск повітря в них падає нижче атмосферного; зовнішнє повітря, за законом Бойля-Маріотта, устремляється в легені до відновлення рівноваги. При видиху об’єм легень зменшується, тиск у них зростає – і повітря виходить назовні. Отже, наші легені фактично працюють як природний насос, підкоряючись газовому закону. Закон Бойля-Маріотта також важливий для метеорології: піднімаючись угору в атмосфері, повітряні маси розширюються (через зменшення зовнішнього тиску) і охолоджуються, що може приводити до утворення хмар і опадів. Без розуміння цієї залежності неможливо пояснити погодні явища, принципи роботи двигунів внутрішнього згоряння, вибухи та багато інших процесів, де гази змінюють об’єм і тиск.
Порівняння підходів Бойля та Маріотта до експерименту і теорії
Хоча Роберт Бойль і Едме Маріотт прийшли до однакового закону, їхні наукові підходи мали свої особливості, зумовлені як особистістю вчених, так і національними школами науки того часу. Метод Бойля вирізнявся сміливістю гіпотез і прагненням теоретизувати на основі експерименту. Він мислив у дусі англійської натурфілософії, що продовжувала традиції Френсіса Бекона – від приватного до загального. Отримавши числові дані, Бойль одразу намагався знайти математичну формулу і пояснити явище через механічну модель (корпускули та пружини)[7]. Його експерименти були масштабними та технічно складними (величезна скляна трубка, громіздкий ручний насос тощо) і вимагали координації зусиль кількох людей – Бойль працював у парі з Робертом Гуком, талановитим механіком і фізиком[3]. Бойль ретельно протоколював усі деталі дослідів, публікував таблиці і графіки, закликаючи колег перевіряти й відтворювати його результати[1]. Він відстоював відкритість наукового знання і вільну дискусію: на критику опонентів Бойль відповідав новими дослідами і публічними демонстраціями (наприклад, його друге видання “Нових експериментів” 1662 року містило спеціальний додаток у відповідь на зауваження скептиків)[1]. В цілому, підхід Бойля був емпірично-теоретичним: експеримент для нього був засобом виявити кількісні закони природи, які потім узгоджувалися з раціональними уявленнями про будову матерії.

Метод Маріотта можна охарактеризувати як більш обережний та емпіричний у чистому вигляді. Маріотт, працюючи у французькій Академії, дотримувався правила не висувати пояснень, які не підкріплені кількома незалежними доказами. Він прославився саме мистецтвом експерименту: умінням продумати тонкий дослід, максимально ізолювати в ньому ключові фактори і досягти точності вимірювань. Так, у випадку із законом газів Маріотт приділив увагу тому, що результати залежать від температури, і чітко прописав цю умову[1]. Саме завдяки Маріотту наука усвідомила необхідність контролювати температурний режим під час дослідів із газами. Крім того, Маріотт запровадив корисну термінологію (“барометр”) і порівняв поведінку повітря з поведінкою рідин (його досліди з рівнем ртуті нагадували гідростатичні досліди Паскаля). Маріотт менше уваги приділяв побудові моделей будови газу – в його працях не знайти детального аналога бойлевих “невидимих пружин”. Натомість він зосередився на логіці дослідження: у своєму трактаті з логіки Маріотт виклав правила наукового умовиводу і підкреслював значення сумніву та перевірки в науці. Таким чином, якщо Бойля можна вважати революціонером, що ламав традиційну схоластику експериментом і новою теорією, то Маріотт був еволюціонером, який вдосконалював експериментальну методику і тим самим теж сприяв народженню нової науки. Обидва вчені доповнили один одного: Бойль дав науці кількісний закон і сміливе його тлумачення, а Маріотт перевірив закон на ширшому емпіричному матеріалі та уточнив умови його застосування[1].
Варто зазначити, що обидва дослідники працювали в руслі механістичного світогляду XVII століття. Вони трактували газ як фізичне тіло, підвладне тим самим законам, що й тверді чи рідкі тіла (пружність, гідростатичний тиск тощо). Це було прогресивним кроком: повітря перестало бути “ефірним” невловимим елементом і перетворилося на об’єкт точного вимірювання. Бойль і Маріотт, кожен у своїй країні, заклали підвалини експериментальної фізики та хімії газів. Їхні підходи дещо різнилися, але збіглися в головному – у визнанні пріоритету досліду над авторитетом. І в Англії, і у Франції сформувалася спільнота вчених (Королівське товариство та Академія наук), які ставили експеримент на чільне місце. Це забезпечило успіх подальших відкриттів на терені вивчення газів.
Значення відкриття для розвитку термодинаміки та молекулярно-кінетичної теорії
Відкриття закону Бойля-Маріотта стало поворотним моментом у фізиці і хімії. По-перше, воно започаткувало серію досліджень газів, що протягом наступних двох століть призвела до створення загального рівняння стану газу і науки термодинаміки. У кінці XVIII – на початку XIX століття були відкриті інші газові закономірності: залежність об’єму від температури при сталому тиску (закон Гей-Люссака, 1802 рік) та залежність тиску від температури при сталому об’ємі (закон Шарля, відкритий Г. К. Ленуаром і Ж. Шарлем, 1780-ті). Французький інженер Бенуа Клапейрон у 1834 році першим об’єднав усі ці емпіричні газові закони (Бойля-Маріотта, Гей-Люссака, а згодом і закон Авогадро) в єдине рівняння стану ідеального газу. Це рівняння (p·V = R·T для 1 моля газу) стало наріжним каменем класичної термодинаміки, дозволивши кількісно описувати процеси, пов’язані з теплотою і роботою у газах. В середині XIX ст. на основі газових законів були відкриті перший та другий закони термодинаміки (роботи Дж. Джоуля, С. Карно, Р. Клаузіуса), що пояснювали взаємозв’язок між тепловою енергією та механічною роботою. Таким чином, закон Бойля-Маріотта історично став одним із підмурків термодинаміки як науки: ще до появи самого терміна “термодинаміка” (введеного у 1849 році лордом Кельвіном) він задав форму рівнянь, якими оперувала ця наука.

По-друге, закон Бойля-Маріотта мав величезне значення для розвитку молекулярно-кінетичної теорії газів. Першу спробу дати теоретичне обґрунтування закону зробив все той же Ісаак Ньютон. У знаменитих «Началах»(1687) Ньютон показав, що якщо припустити існування розрідженого пружного середовища з частинок, між якими діють сили відштовхування, обернено пропорційні відстані, то тиск такого середовища повинен бути прямо пропорційним його густині[7]. А оскільки густина обернено пропорційна об’єму, то виконується закон Бойля (Ньютон писав про нього, посилаючись на Бойля і Маріотта). Цей розгляд був блискучою ілюстрацією механістичного підходу, проте він не враховував температури і природи самих “сил відштовхування”. Пізніше стало зрозуміло, що причина тиску – це удари рухомих молекул об стінки, а не статичне відштовхування на відстані. Потрібна була нова модель – кінетична. Першим її успішно застосував швейцарський математик Даніель Бернуллі. У 1738 році в трактаті «Гідродинаміка» він розглянув газ як безліч швидких частинок, що пружно відбиваються від стінок, і строго вивів рівняння стану газу на основі механіки: тиск пропорційний кількості ударів молекул, тобто густині і квадрату середньої швидкості. При сталості температури (зв’язаної з середньою кінетичною енергією) цей вивід безпосередньо дав закон Бойля-Маріотта[7]. Робота Бернуллі залишалася мало відомою, але в XIX столітті до його ідей повернулися Рудольф Клаузіус, Джеймс Клерк Максвелл і Людвіг Больцман, розбудувавши молекулярно-кінетичну теорію. Вони показали, що газові закони (Бойля-Маріотта, Гей-Люссака та ін.) випливають із простих моделей: молекули рухаються хаотично, їхні зіткнення пружні, і кількість молекул дуже велика. Так, закон Бойля-Маріотта отримав глибоке пояснення: при даній температурі середня енергія молекул фіксована, тому згущення молекул (збільшення густини при стисненні об’єму) веде до пропорційного зростання тиску – що й спостерігали Бойль та Маріотт емпірично. Цей успіх кінетичної теорії утвердив уявлення про реальність молекул і атомів, подолавши залишки скептицизму у науковому середовищі[7].
Насамкінець, важливо підкреслити, що закон Бойля-Маріотта став першою ластівкою кількісних законів природи Нового часу. Його відкриття продемонструвало силу поєднання експерименту і математичного аналізу. Від класичного закону Бойля-Маріотта веде прямий шлях до всіх наступних відкриттів у фізиці газів, хімічній кінетиці, а також до інженерних досягнень – від парової машини до реактивного двигуна. Кожного разу, коли ми користуємося аерозольним балончиком чи автомобільним двигуном, ми фактично маємо справу з проявами закону Бойля-Маріотта. Цей закон – один із наріжних каменів фізики – зберігає своє фундаментальне значення і сьогодні, нагадуючи про геніальні прозріння вчених XVII століття, які вперше зрозуміли «як дихає» газ.
Список використаних джерел:
Christy Martin. Full Boyle // Distillations, Science History Institute, 13 травня 2012 р. – URL: https://www.sciencehistory.org/stories/magazine/full-boyle .
Encyclopædia Britannica. Edme Mariotte – Britannica Online. – URL: https://www.britannica.com/biography/Edme-Mariotte .
Encyclopædia Britannica. Robert Boyle – Summary – Britannica Online. – URL: https://www.britannica.com/summary/Robert-Boyle .
Encyclopædia Britannica. Boyle’s law | Definition, Equation, & Facts. – URL: https://www.britannica.com/science/Boyles-law .
William Fox. Edme Mariotte // Catholic Encyclopedia. Vol. 9. New York: Robert Appleton Company, 1910. – URL: http://www.newadvent.org/cathen/09671a.htm .
KNF Neuberger. The History of the Vacuum and the “Fear of Empty Space” – Корпоративний блог, 26.01.2021. – URL: https://knf.com/en/global/stories-events/news-stories/article/history-vacuum .
Wikipedia. Boyle’s law – Wikipedia, the Free Encyclopedia. – URL: https://en.wikipedia.org/wiki/Boyle%27s_law.
Wikipedia. Edme Mariotte – Wikipedia, the Free Encyclopedia. – URL: https://en.wikipedia.org/wiki/Edme_Mariotte .




Коментарі